L'equilibrio del sistema si altera quando si ha una variazione di grandezze energetiche chiamate "Funzioni di stato" come l'Energia interna (U), l'Entalpia (H), l'Entropia (S) e l'Energia Libera (G).
In questo post tratteremo l'Entropia; per comprendere meglio il significato di questa grandezza, però, inizieremo spiegando il primo principio della Termodinamica.
Il primo principio della Termodinamica afferma che il calore fornito ad un sistema termodinamico (Q) non viene convertito totalmente in lavoro (L), ma fa aumentare anche l'energia interna del sistema (U).
Q= ΔU+ L
 Ricordiamo che ΔU è la differenza di energia interna del sistema finale e iniziale.
Ricordiamo che ΔU è la differenza di energia interna del sistema finale e iniziale.Il calore Q assume segno positivo se è assorbito dall'ambiente esterno (+Q), mentre assume segno negativo se viene ceduto all'ambiente esterno dal sistema (-Q).
Il lavoro L presenta segno positivo se viene compiuto dal sistema sull'ambiente (+L), mentre presenta segno negativo quando è compiuto dall'ambiente sul sistema (-L).
I sistemi termodinamici più studiati sono quelli in cui sono presenti gas; in questo caso il lavoro L è uguale a:
L= PV
In questo caso il primo principio della Termodinamica può, dunque, essere scritto in questo modo:
Q= ΔU + PV
In particolare a pressione costante (trasformazioni isobare):
Queste trasformazioni sono quelle più studiate dalla Termochimica ed è a questo punto che ora introdurremo il concetto di Entalpia.
L'Entalpia (H) è una funzione di stato che indica il contenuto termico di un sistema.
H= ΔU + PV
La sua variazione è:
ΔH= ΔU + PΔV
La variazione ΔH di una trasformazione isobara è quindi uguale al calore Q del sistema.
ΔH= Q= ΔH2- ΔH1
Il calore (Q) di un sistema termodinamico a pressione costante è uguale alla variazione di Entalpia tra lo stato finale e quello iniziale.
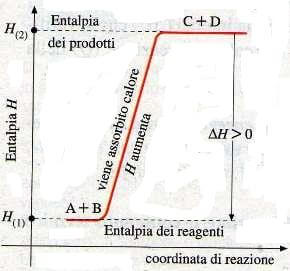
Consideriamo ora una reazione endotermica.
Il contenuto termico dei prodotti è maggiore rispetto a quello dei reagenti (+Q), quindi ΔH>0.
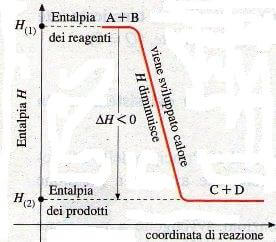
Consideriamo ora una reazione esotermica,
Il contenuto termico dei prodotti è minore rispetto a quello dei reagenti (-Q), quindi ΔH<0.
Fonti:
Il mio libro di chimica
Wikipedia
ChimicaOnline
Google immagini
Nessun commento:
Posta un commento