Oggi cominceremo ad occuparci della Termochimica, ovvero di quella branca della chimica che studia le variazioni termiche durante una reazione.
Ovviamente la Termochimica si basa moltissimo su argomenti relativi alla Termodinamica e per questa ragione credo sia giusto "rinfrescare" un po' la memoria.
- Concetti di base
La Termodinamica è la branca della Fisica che studia gli scambi e le variazioni di calore all'interno di un sistema termodinamico, ovvero l'insieme di corpi coinvolti nello scambio di calore (Q); il sistema termodinamico è limitato dal resto dell'ambiente da un confine.
- Reazione esotermica ed endotermica
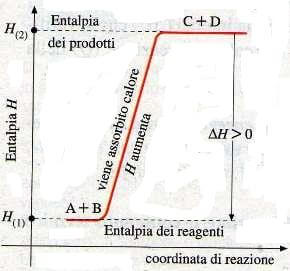 Quando avviene una reazione chimica il calore di reazione (Q) può essere assorbito (+Q) o essere prodotto (-Q). Nel primo caso si dice che la reazione è "Endotermica", mentre nel secondo "Esotermica".
Quando avviene una reazione chimica il calore di reazione (Q) può essere assorbito (+Q) o essere prodotto (-Q). Nel primo caso si dice che la reazione è "Endotermica", mentre nel secondo "Esotermica".
A lato abbiamo un grafico di una reazione generica endotermica.
In questo tipo di reazione il sistema assorbe calore dall'ambiente esterno (+Q) e quindi i prodotti hanno un contenuto termico maggiore rispetto ai reagenti.
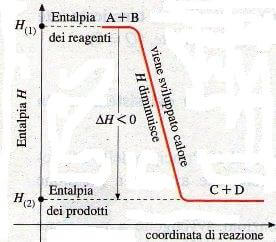
In questo caso, invece, abbiamo una reazione generica esotermica. In questo tipo di reazione viene prodotto calore (-Q) e quindi i prodotti hanno contenuto termico minore rispetto ai reagenti.
Un esempio di reazione esotermica è la combustione.
- Calore specifico e Capacità termica
Calore specifico (c): quantità di calore necessaria per far aumentare di 1°C la temperatura di 1 g di una determinata sostanza. La sua unità di misura è il J/(g °C).
Capacità termica (C): quantità di calore necessaria per far aumentare di 1 °C la temperatura di una sostanza (m qualsiasi). La sua unità di misura J/K.
C= c x m (Formula della capacità termica)
Q= m (Kg) x c (J/g K) x Δt (K) (Legge della calorimetria)
- Energia interna di un sistema (U)
L'energia interna di un sistema termodinamico (U) è data dalla somma dell' energia cinetica media delle particelle e dall'energia potenziale delle particelle.
U= Ec+Ep (Energia interna)
Fonti:
Il mio libro di chimica
Chimicaonline
Nessun commento:
Posta un commento