Ogni soluzione presenta un solvente (la sostanza che scioglie) e un soluto (la sostanza sciolta), ma non sempre un determinata sostanza riesce a sciogliere tutte le altre. La solubilità è caratterizzata dal fatto che si devono stabilire tra le due componenti delle interazioni che dipendono dalla natura dei legami intramolecolari (all'interno di ogni molecola) e intermolecolari (tra le diverse molecole).
Per questa ragione possiamo stabilire due grandi gruppi:- I solventi polari: formati da molecole polari e solventi di sostanze a loro volta polari o solidi ionici.
- I solventi apolari: formati da molecole apolari e solventi di sostanze con molecole apolari.
Questo concetto può essere riassunto in una semplice frase:
"IL SIMILE SCIOGLIE IL SIMILE" (Citazione Prof. Maiolino).
| Svante Arrhenius |
Lo scienziato svedese Svante Arrhenius fu colui che riuscì a spiegare cosa accade quando una sostanza si scioglie in acqua, prestando particolare attenzione agli acidi, agli idrossidi e ai sali.
Arrhenius notò che vi sono diverse modalità di solubilizzazione che dipendono dalle caratteristiche del soluto.
Egli individuò tre diversi processi:
- SOLUBILIZZAZIONE
Un composto che presenta un simile comportamento è il Saccarosio.
- IONIZZAZIONE
 In questo caso il soluto è un composto formato da molecole polari all'interno delle quali vi sono dei forti legami. L'Acqua rompe questi legami e genera ioni positivi e negativi e, quindi, la soluzione riesce a condurre la corrente.
In questo caso il soluto è un composto formato da molecole polari all'interno delle quali vi sono dei forti legami. L'Acqua rompe questi legami e genera ioni positivi e negativi e, quindi, la soluzione riesce a condurre la corrente.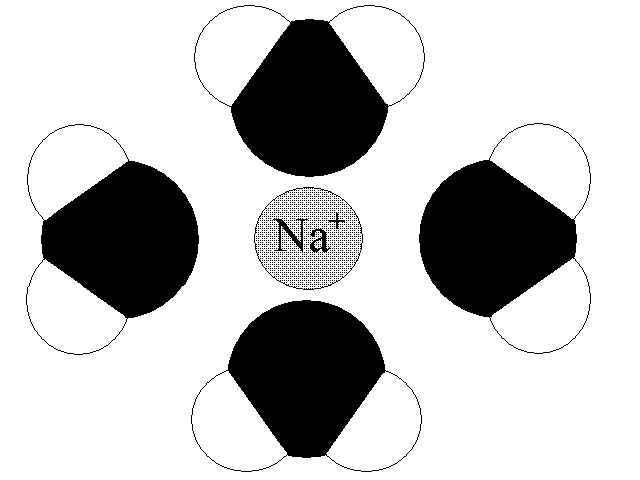
- DISSOCIAZIONE
Un esempio molto semplice è quello del Cloruro di Sodio.
 Arrhenius nei suoi studi in Svezia si è concentrato molto sul comportamento di Acidi, Idrossidi e dei Sali.
Arrhenius nei suoi studi in Svezia si è concentrato molto sul comportamento di Acidi, Idrossidi e dei Sali.Gli Acidi (HnonMeO) disciolti in Acqua producono ioni Idronio e anioni.
Gli Idrossidi (Me(OH)x) producono cationi metallici e anioni OH.
I Sali sciolti in acqua producono anioni e cationi metallici.
Qui sotto trovate una semplice animazione su ciò che accade in una soluzione acqua-cloruro di sodio (NaCl).
Fonti:
Google immagini
Il mio libro di chimica
wikipedia
gooru
youtube
Nessun commento:
Posta un commento